标准物质一站式采购平台
- 产品
- 帖子
- 新闻
标准物质一站式采购平台
根据NoV基因型分型保守区域分别设计出3 组GI型NoV引物、探针和4 组GII型NoV引物、探针,引物探针序列未给出。荧光PCR筛选结果表明,针对GI型和GII型NoV的各组引物探针均能有效扩增出靶基因,其中来源于GB 4789.42—2016《食品微生物学检验 诺如病毒检验》的引物探针COG1-F/R/RING1-P和COG2-F/R/RING2-P具有较高的扩增效率,可筛选分别用于构建GI、GII型NoV RT-ddPCR体系。对其特异性进行验证(图1)。荧光PCR特异性验证结果表明,筛选的GI型NoV特异性COG1-F/COG1-R/RING1-P、GII型NoV引物探针COG2-F/COG2-R/RING2-P和MS2噬菌体引物探针MS2-TM3-F/R/P特异性良好,各筛选的引物探针序列见表1。
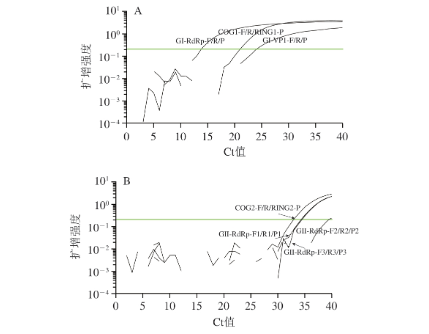
图1 荧光PCR筛选引物探针
表1 筛选的RT-ddPCR引物探针序列
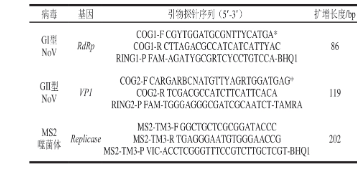
注:*.存在Kageyama引物,Y为C或T,R为A或G,B为非A的其他碱基,N为任意碱基。
RT-ddPCR特异性验证结果表明,3 个RT-ddPCR体系只有各自对应目的片段特异性扩增,其余病毒经检测均呈阴性,证明筛选的3 组引物探针在RT-ddPCR体系中特异性良好(图2)。

图2 RT-ddPCR检测方法特异性实验结果
由图3A、B可见,50 ℃条件下GI、GII型NoV目的基因片段的扩增效率均偏低,阳性微滴和阴性微滴分界不明显;55 ℃和60 ℃条件下目的基因片段扩增效率较高,可出现比较明显的阳性微滴簇,且55 ℃条件下扩增的荧光信号略高于60 ℃,因此,将55 ℃作为GI和GII型NoV RT-ddPCR检测体系的最佳最火温度;由图4C可见,55 ℃条件下MS2噬菌体目的片段的扩增效率偏低,阳性微滴和阴性微滴分界不明显;57.5、60 ℃和62.5 ℃条件下目的基因片段扩增效率较高,阳性微滴和阴性微滴可明显分解,且62.5 ℃条件下扩增的荧光信号略高于57.5 ℃和60 ℃,因此,将62.5 ℃作为最佳退火温度。
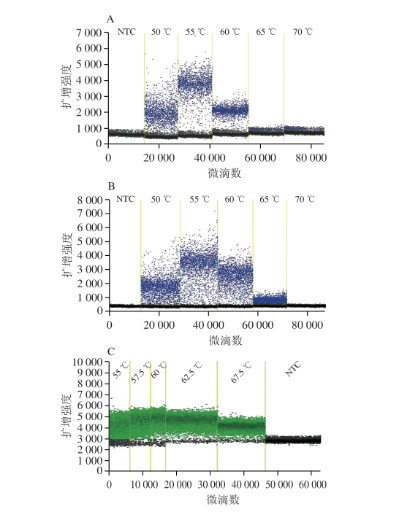
图3 RT-ddPCR检测体系在不同退火温度下扩增结果
对于MS2噬菌体RNA,5 次重复测量得到的核酸浓度平均值为1.269 μg/mL(测量结果未给出)。MS2噬菌体为单链RNA病毒,基因组由3 569 个核苷酸组成,故计算得到的MS2噬菌体RNA拷贝浓度为6.29×108 拷贝/μL。
将GI、GII型NoV RNA标准物质和MS2噬菌体RNA分别按多倍梯度稀释,直至稀释浓度分别为5.4、5.9 拷贝/μL和6.29 拷贝/μL,每个梯度4 个重复实验,分别进行RT-ddPCR检测。结果表明,GI和GII型NoV的RT-ddPCR检测最后两个稀释倍数的RSD均较大,但是均在25%以内,表明这两个检测体系的绝对定量检测灵敏度均可达到5 拷贝/μL;而MS2噬菌体RT-ddPCR检测RSD为4.5%~42.0%,对单个拷贝浓度样品的4 次重复的RSD达到42%,故MS2噬菌体RT-ddPCR检测的绝对定量检测灵敏度可达到10 拷贝/μL梯度。
3 个体系所检测的浓度值与相应的理论浓度值均具有很好的线性关系,并且与理论拷贝数相符,3 个RT-ddPCR检测体系分别能够对GI、GII型NoV和MS2噬菌体进行准确定量。
对于高浓度样品和低浓度样品,3 个RT-ddPCR检测体系的RSD 均小于25%,与理论值的偏差为0.34%~15.63%,单因素方差分析发现,各RT-ddPCR检测体系的3 个重复检测值之间无显著差异(P>0.05),可见RT-ddPCR检测体系的重复性均较好。进一步分析数据发现,高浓度样品3 个平行样品的测定RSD总体上低于低浓度样品,可见模板的浓度对RT-ddPCR检测体系的重复性影响较大,样品浓度范围在103~101数量级范围内时,RT-ddPCR检测体系能够较好地对目的模板进行定量检测。
贝类消化腺(牡蛎消化腺)、硬表面食品(苹果)、生食蔬菜(羽叶生菜)和软质水果(草莓)4 种食品基质中,添加与未添加MS2噬菌体过程控制的平行样品,GII型NoV定量检测结果相近,t检验结果P值均大于0.05,差异无统计学意义。4 种食品基质过程控制回收率分别均大于1%,均符ISO/TS要求。添加了MS2噬菌体的样品可通过将GII型NoV定量检测结果除以回收率,得到NoV载量,均达到了106 拷贝数量级,RSD为2.4%。
实际样品检测结果表明(具体数据未给出),在23 份贝类样品中有2 份检出GII型NoV RNA,检出率为8.70%。硬表面食品、生食蔬菜和软质水果样品中均未检出食源性病毒。不同的食品基质中MS2噬菌体作为过程控制的回收率不同,贝类消化腺中的过程控制回收率在18.2%~78.6%之间,硬表面食品中的过程控制回收率在9.4%~58.2%之间,生食蔬菜中的过程控制回收率在8.5%~32.2%之间,软质水果中的过程控制回收率在1.7%~19.9%之间。
NoV是引起急性暴发非细菌性胃肠炎的首要致病原体,美国疾病控制与预防中心监测研究估计30%~50%的食物源性胃肠炎暴发与NoV有关。NoV通过污染肥料或水体进入食物链,被污染的水体中生长的滤食性贝类,可浓缩水体中的NoV,当人类生食来自被NoV污染水体中的贝类或者食用未熟透的贝类时,可感染NoV;此外携带了NoV的食品加工者也可能将病毒颗粒转移到食品上。由此可见,被NoV污染的食物是其传播的关键,建立科学、高效的食品中NoV检测手段,对控制NoV引起的疾病,保障人民健康具有重要意义。
数字PCR技术将PCR体系分割为许多独立的反应单元,模板在独立的反应单元中进行PCR扩增,检测每个反应单元是否有荧光信号判断是否含有扩增模板,通过泊松统计学处理,不依赖标准曲线和循环阈值可直接定量核酸拷贝数。定量检测RNA时,需要将RNA反转录为cDNA。Kiselinova等在两步法反转录数字PCR对定量检测HIV RNA时,仍然需要依赖标准曲线计算RNA的拷贝浓度。RT-ddPCR可避免反转录给定量结果带来的偏倚,目前已有研究成功利用RT-ddPCR实现水体中的RV RNA直接定量检测,灵敏度与real-time PCR相当。
本研究以实验室保存的GI、GII型NoV RNA标准样品为模板,分析构建的NoV RT-ddPCR检测体系的检出限包括104~100 拷贝/μL 5 个数量级。RT-ddPCR对高浓度模板样本检测能力受限,主要原因是ddPCR平台仅可生成小于20 000 个微滴,当模板浓度达到106 拷贝/μL数量级,不能通过泊松分布计算模板含量。但是对于低浓度模板样本,RT-ddPCR具有较小的变异系数和更高的灵敏度,Tang Hui等结果表明,ddPCR具有更好的可重复性,对低拷贝的质粒标准品的定量检测优于实时荧光PCR。Yan Yong等发现,dd PCR能够从real-time PCR检测阴性的咽拭子标本中检测出流感病毒载量,其检测灵敏度更高。
基于RT-ddPCR技术的食品中NoV定量检测方法,需要构建过程控制程序,采用的模式病毒应具备以下条件:1)可建立RT-ddPCR检测体系,具有与NoV相当的准确性、灵敏度和变异性;2)容易培养,无生物危害,能够确定效价[20];3)与NoV基因有明显区别,不影响检测结果;4)在自然状态中不出现,只能人为添加到被检测食品中。MS2噬菌体是一种无包膜+ssRNA病毒,侵染宿主为F+(雄株)大肠埃希氏菌,大小和结构与NoV比较接近,可通过计数噬菌斑确定其效价,对人体没有致病性,基因组不含NoV的靶基因序列[23-24]。本研究建立了MS2噬菌体RT-ddPCR检测体系,准确性、定量限和重复性与NoV RT-ddPCR检测体系相当,且不影响食品中NoV的RT-ddPCR定量结果,因此,可作为过程控制的模式病毒被添加到食品中指示回收率,计算食品中NoV的实际载量。
本研究建立了基于RT-ddPCR技术的食品中NoV定量检测方法,可定量检测单个拷贝数量级的NoV核酸。NoV通常富集或吸附于不同食品基质内部或者表面,需要经过病毒洗脱浓缩、核酸提取纯化等前处理,才能对食品中的NoV进行定量检测,但是前处理过程往往可导致NoV颗粒大量损失,造成RT-ddPCR定量结果与食品中NoV实际载量不匹配的现象。由此可见,后续需要针对优化NoV洗脱浓缩,改善核酸提取效率,提高NoV整体回收率等方面进一步研究,以提升RT-ddPCR检测体系对食品中NoV定量检测的准确性。
本文章来源于——《食品科学网》,如有版权问题,请与本网联系

错过了直播也不用担心哦,您可以随时点击进入“培训中心”——“线上研讨会”观看回放,或者您也可以关注北纳生物BNCC微信公众号——右下角“直播间”——“进入直播”观看全程精彩回放!
了解更多> >由天津国际生物医药联合研究院主办,商城北纳创联生物科技有限公司承办的“(京津冀)生物制造产业发展论坛”,定于2024年7月24日在天津国际生物医药联合研究院召开。
了解更多> >通话对您免费,请放心接听
温馨提示:
1.手机直接输入,座机前请加区号 如13164239859,010-58103778
2.我们将根据您提供的电话号码,立即回电,请注意接听
3.因为您是被叫方,通话对您免费,请放心接听

登录后才可以评论